FOLDIT
Έργο
Ανάπτυξη ερευνητικής υποδομής στο Ιόνιο Πανεπιστήμιο για τη μελέτη αναδίπλωσης πρωτεϊνών στις νευροεκφυλιστικές ασθένειες (FOLDIT)
Σύντομη περιγραφή
Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. Η λειτουργία τους καθορίζεται από την αλληλουχία των αμινοξέων αλλά και τη σωστή αναδίπλωσή τους κατά το σχηματισμό της τριτοταγούς τους δομής. Αν οι πρωτεΐνες δεν λάβουν την κατάλληλη διαμόρφωση μπορεί να σχηματίσουν αφενός επιφάνειες που παρεμποδίζουν τη φυσιολογική σύνδεση με άλλα βιομόρια, αφετέρου δημιουργούν συσσωματώματα τα οποία είναι ιδιαίτερα τοξικά για τον οργανισμό. Αυτά τα συσσωματώματα αποτελούν κοινό γνώρισμα πολλών νευροεκφυλιστικών ασθενειών, όπως τα ινίδια αμυλοειδούς στη νόσο Alzheimer λόγω εναποθέσεων β-αμυλοειδούς, α-συνουκλεϊνης στη νόσο Πάρκινσον και prions στην Creutzfeldt–Jakob. Στόχος του παρόντος έργου αποτελεί η ανίχνευση και η μελέτη της αναδίπλωσης χαρακτηριστικών πρωτεϊνικών μοτίβων που εμπλέκονται στους μηχανισμούς εκδήλωσης νευροεκφυλιστικών ασθενειών μέσω εξειδικευμένων πειραματικών διατάξεων όπως η μικροσκοπία ατομικών δυνάμεων και κατάλληλων υπολογιστικών προσεγγίσεων. Η μέχρι σήμερα ελλιπής κατανόηση αναφορικά με τον τρόπο που οι πρωτεΐνες αναδιπλώνονται στο χώρο και αλληλοεπιδρούν με άλλες πρωτεΐνες του κυττάρου αποτελούν ένα στοίχημα για την ερευνητική κοινότητα. Επιμέρους στόχοι του έργου αποτελούν η απεικόνιση των μορφολογικών χαρακτηριστικών και της χωρικής κατανομής των πρωτεϊνικών συσσωματωμάτων σε συνάρτηση με το χρόνο ενώ ιδιαίτερη έμφαση θα δοθεί στο ελάχιστο χρονικό πλαίσιο που απαιτείται για την απεικόνιση των πρωτεϊνικών μοτίβων συσσωμάτωσης.
Σκοπός
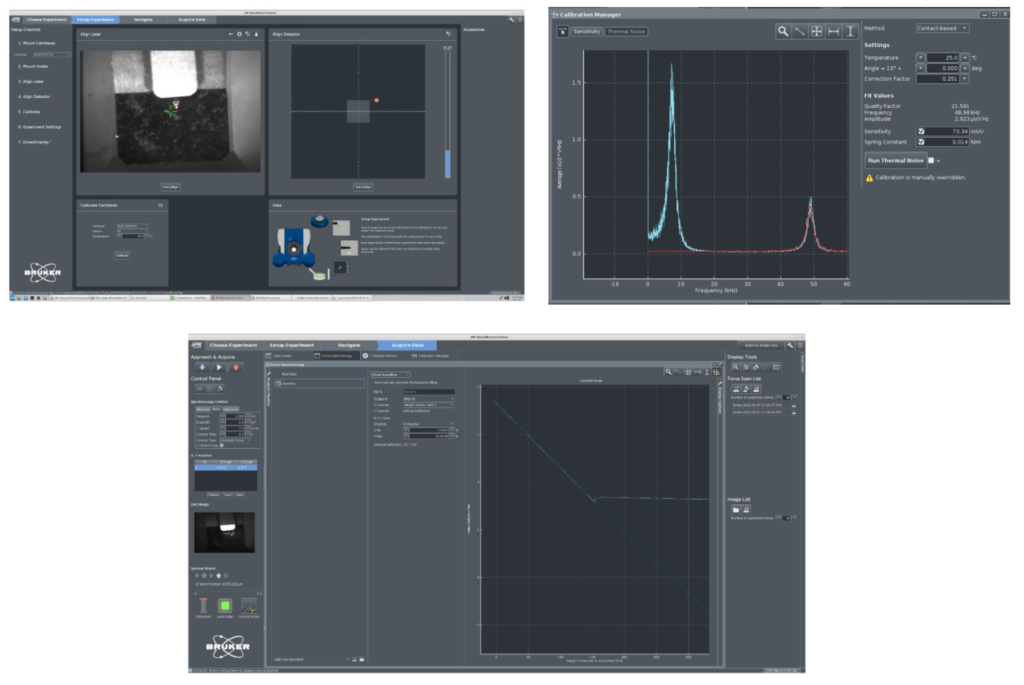
Στα πλαίσια του παρόντος έργου θα πραγματοποιηθούν μελέτες ελέγχου μοτίβων πρωτεϊνικής αναδίπλωσης σε επιλεγμένες πρωτεΐνες-στόχους για εξαγωγή χρήσιμων συμπερασμάτων ως προς το ρόλο της ελαττωματικής αναδίπλωσης και σχηματισμού συσσωματωμάτων. Η επιλογή των πρωτεϊνών θα γίνει βάσει κατάλληλων κριτηρίων (αμινοξική αλληλουχία, περιοχή φωσφορυλίωσης) ενώ για την ανάλυση των αποτελεσμάτων και την ερμηνεία των δεδομένων θα εφαρμοστούν κατάλληλα λογισμικά επεξεργασίας. Η πρωτοτυπία της μελέτης έγκειται σε γεγονός ότι θα πραγματοποιηθεί με τη χρήση εξειδικευμένης πειραματικής μεθοδολογίας όπως η μικροσκοπία ατομικών δυνάμεων η οποία δύναται να καταστήσει εφικτή την παρατήρηση χρονοεξαρτώμενης συσσωμάτωσης πρωτεϊνικών μορίων σε επαφή με δύο μοντέλα στερεών επιφανειών και την εξαγωγή επιμέρους κινητικών παραμέτρων. Το μικροσκόπιο ατομικής δύναμης ForceRobot® 300 (JPK BioAFM Bruker, Germany) που θα χρησιμοποιηθεί στα πλαίσια του έργου αποτελεί μία πλήρως αυτοματοποιημένη πειραματική διάταξη για διεξαγωγή δυναμικής φασματοσκοπίας που επιτρέπει την απεικόνιση και μελέτη της βραχύβιας αναδίπλωσης και αποδιάταξης μεμονωμένων βιολογικών μακρομορίων. Στους στόχους του έργου FOLDIT περιλαμβάνονται:
Εγκατάσταση εξοπλισμού, παραμετροποίηση, λειτουργία και εκπαίδευση
Η 1η ενότητα εργασίας (ΕΕ1) περιλαμβάνει την προμήθεια του απαραίτητου εξοπλισμού (ForceRobot®300) στο Εργαστήριο Βιοπληροφορικής και Ανθρώπινης Ηλεκτροφυσιολογίας του Τμήματος Πληροφορικής του Ιονίου Πανεπιστημίου. Θα γίνουν τα απαραίτητα βήματα για την εγκατάσταση του εξοπλισμού στο εργαστήριο, την παραμετροποίηση του και τον έλεγχο της λειτουργικότητας. Επιπλέον, σε αυτό το πακέτο εργασίας θα πραγματοποιηθεί η εκπαίδευση του προσωπικού του εργαστηρίου για τη λειτουργία του εξοπλισμού από το προσωπικό της προμηθεύτριας εταιρείας.
Έγκριση μελέτης, συλλογή δεδομένων και διεξαγωγή πειραμάτων
Η 2η ενότητα εργασίας (ΕΕ2) περιλαμβάνει την έγκριση μελέτης για ανάλυση επιλεγμένων πρωτεϊνών-στόχων μέσω του εξειδικευμένου εξοπλισμού. Το μικροσκόπιο ατομικών δυνάμεων επιτρέπει την απεικόνιση και την ανίχνευση των αλληλεπιδράσεων μεμονωμένων μορίων και τη διερεύνηση των εσωτερικών μοριακών ιδιοτήτων όπως η ελαστικότητα της δομής τους κατά την απώλεια της τριτοταγούς δομής τους. Μπορούν επίσης να διερευνηθούν οι κινητικές παράμετροι της ελαττωματικής αναδίπλωσης κατά την αλληλεπίδραση των πλευρικών ομάδων των αμινοξέων και να γίνει κατανοητή η διαφοροποίηση μεταξύ προσδέτη και αναστολέα μεταβάλλοντας συγκεκριμένες πειραματικές παραμέτρους.
Ανάλυση των αποτελεσμάτων σχετικά με την λανθασμένη αναδίπλωση των πρωτεϊνών
Η 3η ενότητα εργασίας (ΕΕ3) περιλαμβάνει μεθοδολογίες ανάλυσης των δεδομένων που θα προέλθουν από την ΕΕ2 χρησιμοποιώντας τεχνικές στατιστικής και εξόρυξης δεδομένων για την αντιμετώπιση των βασικών ερευνητικών ερωτημάτων σχετικά με την ελαττωματική αναδίπλωση των πρωτεϊνών και τη συσχέτισή τους με νευροεκφυλιστικά νοσήματα όπως επίδραση pH στην αναδίπλωση των πρωτεϊνών, καμπύλες απόστασης ισχύος με ενιαία ρήξη, καμπύλες απόστασης ισχύος με μοτίβο πολλαπλής ρήξης, παράμετροι συσσώρευσης, στόχευση της ελαττωματικής αναδίπλωσης.
Μελέτη σκοπιμότητας και σχεδιασμός βιωσιμότητας για μακροχρόνια χρήση του εξοπλισμού, συμπεριλαμβανομένων των πολιτικών χρήσης
Η 4η ενότητα εργασίας (ΕΕ4) περιλαμβάνει τον έλεγχο της σκοπιμότητας και τη βιωσιμότητα της ερευνητικής υποδομής μετά το πέρας της χρηματοδότησης και να καθορίσει τις πολιτικές χρήσης. Η μελέτη βιωσιμότητας θα αναδείξει τρόπους έτσι ώστε τα αποτελέσματα της ερευνητικής δραστηριότητας να χρησιμοποιηθούν από άλλους φορείς ενώ ως προς τις πολιτικές χρήσεις θα γίνει μελέτη προσβασιμότητας της ερευνητικής υποδομής στο ευρύ κοινό, καθώς και πλάνο ενσωμάτωσης της ερευνητικής υποδομής σε μεγάλα Ευρωπαϊκά και Διεθνή Δίκτυα Ερευνητικού Εξοπλισμού.
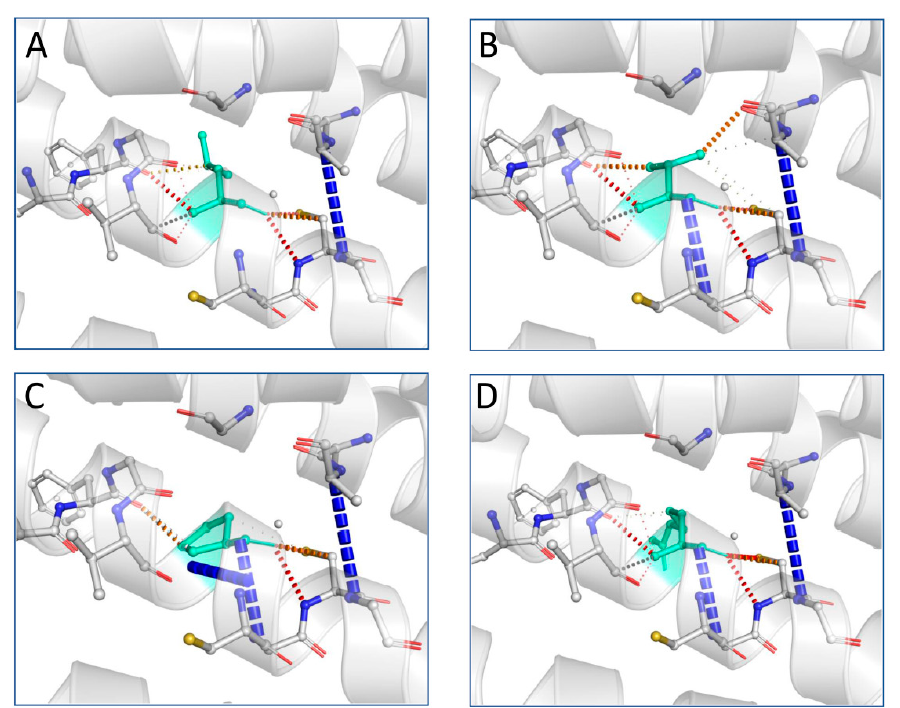
Το γονίδιο του χρωμοσώματος Χ PLP1 κωδικοποιεί την πρωτεολιπιδική πρωτεΐνη της μυελίνης (PLP), την πιο διαδεδομένη πρωτεΐνη στο περίβλημα της μυελίνης που περιβάλλει το κεντρικό νευρικό σύστημα. Η ανάλυση μέσω εργαλείων πρόβλεψης δομής έδειξε ότι οι περισσότερες από τις παραλλαγές μπορούν να αλλάξουν τη λειτουργικότητα της δομής της πρωτεΐνης και η απώλεια της θερμοδυναμικής σταθερότητας της πρωτεΐνης μπορεί να μειώσει την ικανότητα της δομής να επιτελεί φυσιολογικές λειτουργίες. Η πρόβλεψη για συγκεκριμένες μεταλλάξεις όπως τις L31P, L31V και L31R έδειξε ότι μπορούν οδηγήσουν σε αλλοιωμένη διαμεμβρανική πρωτεΐνική διαμόρφωση ενώ η παραλλαγή R137W παίζει ουσιαστικό ρόλο στη χωροδιάταξη της διαμεμβρανικής πρωτεΐνης. Πραγματοποιήθηκε παράλληλα μελέτη της μοριακής επίδρασης των επιλεγμένων παραλλαγών με τις L31V, L31P L31R να χαρακτηρίζονται από μείωση της σταθερότητας αυξάνοντας ταυτόχρονα τη μοριακή ευελιξία της πρωτεΐνης αγρίου τύπου σε αντίθεση με την παραλλαγή H140Y που ενίσχυσε τη σταθερότητα της πρωτεΐνης.
| Παραλλαγή | ΔΔG (kcal/mol) | Αποτέλεσμα | ΔΔSVibENCoM (kcal.mol-1.K-1) | Αποτέλεσμα |
| L31V | -0.133 | αποσταθεροποίηση | 0.083 | αύξηση |
| L31P | -1.011 | αποσταθεροποίηση | 0.413 | αύξηση |
| L31R | -0.256 | αποσταθεροποίηση | 0.231 | αύξηση |
| R137W | -0.400 | αποσταθεροποίηση | 0.111 | αύξηση |
| H140Y | 0.519 | σταθεροποίηση | -0.063 | μείωση |



